MinerOss® A – humanes Knochenersatzmaterial
Schnelle Integration und Remodelling
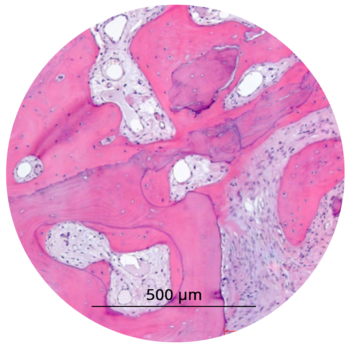
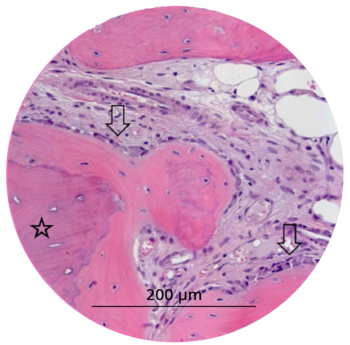
MinerOss® A ist ein aus menschlichem Spenderknochen hergestelltes Allograft. Wissenschaftliche Studiendaten zeigen, dass Allografts in der Anwendung den patienteneigenen Knochen am ähnlichsten sind. Sie integrieren schnell und haben das Potenzial für ein Remodelling.1–5
MinerOss® A wird von der Cells+Tissuebank Austria (C+TBA) in einem mehrstufigen Reinigungsprozess für die sichere Anwendung verarbeitet – nachdem das Spendergewebe einem stringenten serologischen Screening-Protokoll unterzogen wurde. Es besteht aus allogenem Knochengewebe und ermöglicht zuverlässige und vorhersagbare Ergebnisse zur Regeneration von Knochendefekten.
MinerOss® A wird hauptsächlich aus gespendeten humanen Femurköpfen gewonnen, die nach Hüftgelenkersatz-OPs eingeschickt und gescreent werden. Es ist als Granulat, Block und Platte erhältlich.
Dank der natürlichen Zusammensetzung des Knochens, der mineralisiertes humanes Kollagen enthält, zeigt MinerOss® A eine hohe biologische Regenerationsfähigkeit in Kombination mit einem natürlichen Remodelling-Verhalten.2 Daher ist MinerOss® A eine hervorragende Alternative zur Knochenentnahme beim Patienten. Ein chirurgischer Eingriff zur Entnahme eines autologen Transplantats entfällt, wodurch die Morbidität für den Patienten verringert wird.
Produktmerkmale von MinerOss® A
Spongiöse und kortiko-spongiöse Produkte
Beim Herstellungsprozess von MinerOss® A werden hohe Sicherheitsstandards eingehalten, die eine Haltbarkeit von fünf Jahren bei Raumtemperatur (5–30 °C) gewährleisten. MinerOss® A wird als spongiöses und kortiko-spongiöses Granulat hergestellt. Die Spongiosastruktur ermöglicht einen schnellen Knochenaufbau bei eingegrenzten Defekten wohingegen die kortiko-spongiösen Produkte für mehr Volumenstabiliät außerhalb der Kontur sorgen.
- Geschützter Gewebeverarbeitungsprozess erhält die Gewebeintegrität
- Knochen von Humanspendern (Lebendspender: Femurköpfe; Post-mortem-Spender: Röhrenknochen/Diaphyse)
- Natürliche Knochenzusammensetzung – mineralisiertes humanes Kollagen
- Hohe biologische Regenerationsfähigkeit und natürliches Remodelling2
- Osteokonduktive Eigenschaften unterstützen den kontrollierten Gewebeumbau
- Haltbarkeit fünf Jahre bei Raumtemperatur (5–30 °C)
- Kürzere Operationsdauer – durch den Verzicht eines zweiten chirurgischen Eingriffs zur Transplantatentnahme
- Geringere Komorbidität – keine zusätzlichen postoperativen Schmerzen
- Unbegrenzte Verfügbarkeit – keine Mengenlimitation wie beispielsweise bei intraoraler Entnahmestelle
- Kein klinischer Unterschied in der endgültigen Integration im Vergleich zu autologem Knochen3, 5, 6
Ideal für folgende Indikationen
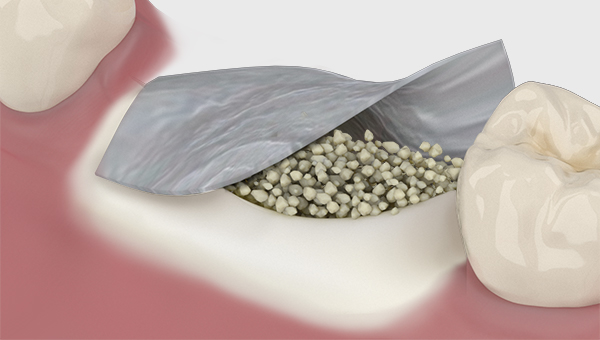
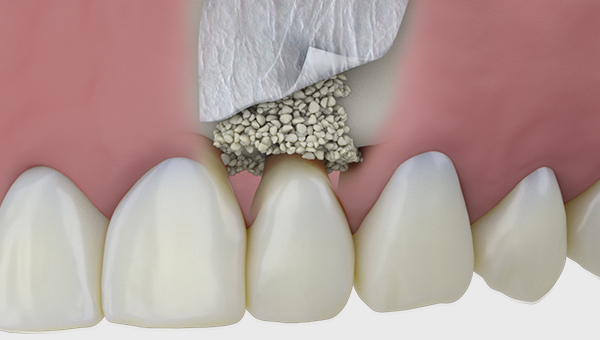
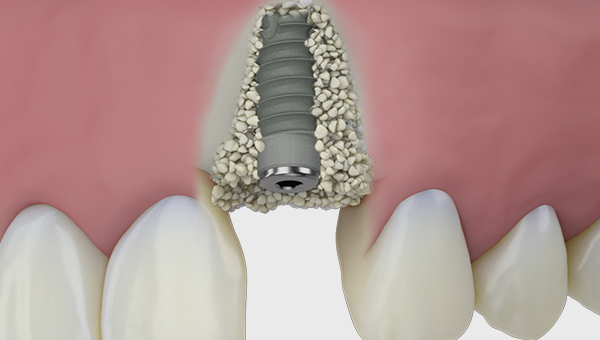
Regeneration und Augmentation
Die therapeutischen Maßnahmen zum Knochenaufbau werden abhängig von der Größe, den Begrenzungen sowie der Lage des Defekts festgelegt. Um volumenstabilen Knochen, zum Beispiel für die sichere Verankerung eines Implantats zu erzielen, wird der Defekt im Sinne der Guided Bone Regeneration aufgebaut. Bei der Augmentation großer beziehungsweise komplexer Defekte muss das Knochenersatzmaterial mithilfe einer Membran geschützt und stabilisiert werden, um die Wundheilung zu fördern und damit die Geweberegeneration ungestört stattfinden kann.
MinerOss® A eignet sich für die ...
- Regeneration parodontaler knöcherner Defekte, auch nach Zysten oder Wurzelspitzenresektionen
- Regeneration von Extraktionsalveolen und Lücken zwischen Alveolarwand und Dentalimplantaten
- Sinusbodenaugmentation
- horizontale Kieferkammaugmentation
- dreidimensionale (horizontale und/oder vertikale) Augmentation des Kieferkamms
Herstellungsprozess von MinerOss® A
Hohe Sicherheitsstandards
Nach einer sorgfältigen Anamnese des Spenders wird durch eine Reihe stringenter serologischer Tests in Kombination mit dem Allotec® Aufreinigungsverfahren von C+TBA und der Sterilisation durch Gammabestrahlung eine maximal mögliche Sicherheit gewährleistet.
Zuerst werden serologische und nukleinsäurebasierte Tests (nucleic acid based tests, NAT) durchgeführt, um Infektionen festzustellen, bevor diese über Antikörperbildung sichtbar werden können. Während des Allotec® Aufreinigungsverfahrens werden potenziell vorhandene Viren inaktiviert und Bakterien zerstört, außerdem werden nicht-kollagene Proteine denaturiert.
Noch verbliebene lösliche Proteine werden anschließend durch eine oxidative Behandlung denaturiert, wodurch auch die potenzielle Antigenität eliminiert wird. Schließlich wird das Gewebe dehydriert – durch ein Lyophilisationsverfahren, das die Sublimation von gefrorenem Gewebewasser von fest zu gasförmig erleichtert. Dadurch bleibt die strukturelle Integrität des Materials erhalten. Der Lyophilisationsprozess ist ein anerkanntes und gut dokumentiertes Verfahren, durch das einerseits die Strukturmerkmale erhalten bleiben, andererseits die Integration des Transplantats verbessert wird.7, 8
Die mikroskopisch kleinen Poren im Material ermöglichen die rasche Rehydratation des Gewebes bei der Anwendung. Die abschließende Sterilisation durch Gammabestrahlung gewährleistet ein Sterilitätssicherheitsniveau (SAL-Wert) von 10–6 und stellt zudem die strukturelle und funktionelle Integrität des Produkts und seiner Verpackung sicher.
Der Allotec® Prozess
Unabhängige Validierung der kritischen Prozessschritte zur viralen Inaktivierung
Pflichtangaben
MinerOss® A wird bei Kleinkindern, Kindern, Jugendlichen und Erwachsenen angewendet zur Transplantation als Ersatz für verloren gegangenes und insuffizientes Gewebe und zum Auffüllen und zur Stabilisierung von Knochendefekten in der Orthopädie, Unfallchirurgie sowie Kiefer und Gesichtschirurgie. Der Einsatz in weiteren Fachdisziplinen ist denkbar.
Referenzen
1 Schmitt et al. Clin Oral Implants Res. 2013, 24, 576.
2 Solakoglu et al. Clin Implant Dent Relat Res. 2019, 21, 1002-1016.
3 Kloss et al. Clin Case Rep. 2020, 8, 5.
4 Wen et al. J Periodontol. 2020 Feb;91(2):215-222
5 Kloss et al. Clin Oral Implants Res. 2018, 29, 1163.
6 Tunkel et al. Clinical Case Reports 2020, 00:1-13.
7 Trajkovski et al. Materials 2018, 11(2).
8 Barbeck et al. Materials 2019, 12, 3234.